eccDNA的长度、分类、形成原因、研究历程、功能探索和未来展望等方面的研究
一、什么是eccDNA
对于eccDNA的定义不同学者在各自的文献报道中的陈述存在一定的差异。
目前的观点认为,eccDNA大致可分为两类,
即狭义的eccDNA和在肿瘤中常见的染色体外DNA(Extrachromosomal DNA,ecDNA)。
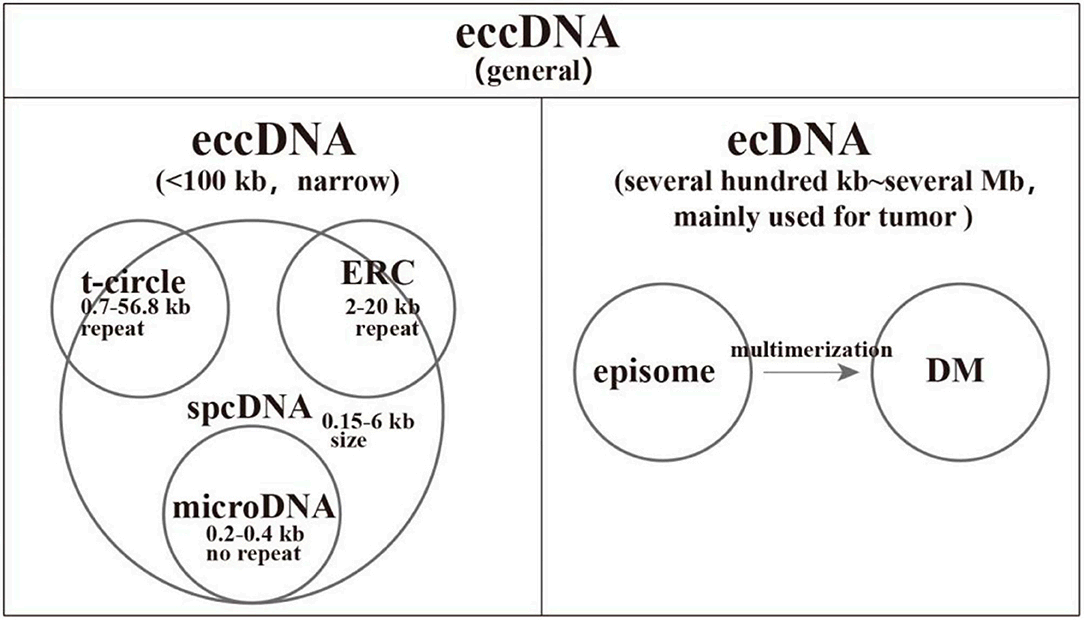
狭义的eccDNA,长度小于100 kb,以及覆盖DMs和外源体的ecDNA(1),
广泛存在于人类正常细胞、癌细胞以及动物和植物中,涵盖了正常和肿瘤细胞,
这类eccDNA长度通常在几百bp至上千bp之间存;
而ecDNA是指在肿瘤中检测到的大型eccDNA(15)。
它经常携带着关键的癌基因,对于肿瘤的发生、发展,以及对治疗药物的抵抗等方面产生影响。

二、eccDNA长度和分类
eccDNA的长度变化范围非常广泛,从数千到数百万个碱基对不等,具体取决于其所携带的遗传信息以及来源的不同。

根据DNA长度,学者们将其分为spcDNA、T-circle、ERC、microDNA、ecDNA。
spcDNA,英文全称是Small polydispersed circular DNA,
通常用来描述长度约为0.05-2.00µm的小型环状细胞外DNA(eccDNA)(2)。
ERC和t-circle,仅带有rDNA和端粒DNA的spcDNA被专门称为ERC和环T-circles(15)。
长度分别介于0.7KB至56KB之间与2KB至20KB之间,它们有的长度大于spcDNA,意味着一些ERC和t-circles并未包括在spcDNA内(3, 4, 5)。
microDNA,具有大约200-400 bp的非重复序列,
来源于5' UTRs、外显子和CpG islands,microDNA的丰度很高,通常每个细胞中有几百到几千个计数(6, 7)。
ecDNA,英文全称是Extrachromosomal DNA,
ecDNA是指在肿瘤中检测到的大型eccDNA,长度大于几百KB,有的甚至能达到几个MB。
三、eccDNA的形成
eccDNA的产生是一个复杂的过程,涉及到多种机制和条件。
虽然我们对其形成的详细过程还不完全清楚,但有一些已知的产生途径:
1. 基因组不稳定性和复制压力:
染色体不稳定性和复制压力被认为是eccDNA形成的原因之一。
细胞在高度增殖状态下,尤其是在癌症细胞中,可能会面临复制压力,促使染色体片段环状化形成eccDNA(8)。
2. DNA损伤修复:
DNA双链断裂和其他损伤可能导致eccDNA的形成。
细胞为了修复DNA损伤,可能会启动非同源末端连接或其他机制,导致环状DNA的产生(9)。
3. 复制起点缺失:
染色体上复制起点的缺失可能促使染色体片段形成环状结构。
这一机制可能与复制起点的丧失和染色体重排有关(10)。
4. 细胞应激和环境因素:
细胞应激和环境因素,如辐射、药物暴露等,可能触发eccDNA的形成。
这些外部刺激可能导致DNA断裂和损伤,从而促使eccDNA的产生(11)。
这些过程可能单独或联合起来促成eccDNA的形成。
值得注意的是,eccDNA的产生可能是细胞内多种因素相互作用的结果,
并且其形成机制可能因细胞类型、环境因素和遗传背景而异。
对eccDNA形成机制的深入研究有助于更好地理解其在细胞生物学和疾病发生中的作用
四、eccDNA的主要研究历程
1965年:首次发现染色质外环状DNA双微体
1978年:氨甲喋呤耐药细胞双微体携带DHFR基因
1984年:CHO细胞中发现小分散环状DNA(spcDNA)
1987年: Episome概念提出;发现T细胞受体重排过程生成环状DNA
2012年:小鼠和人的细胞中大量存在microDNA
2017年:2572种肿瘤细胞系基因组测序,发现eccDNA常携带肿瘤驱动基因
1983年:神经母细胞瘤双微体携带MYCN基因;肠癌双微体携带c-Myc基因
1986年:发现放线菌酮,致癌剂,DNA复制抑制剂羟基脲均能促进eccDNA生成
1989年:发现携带MDR1基因的双微体与基因组DNA复制机制相同
2014年:胶质瘤细胞中存在携带EGFRvII突变型基因的eccDNA,介导EGFR抑制剂耐药。
2018年:健康人的肌肉和血液细胞中分离到超过十万种的eccDNA分子
2019年:eccDNA染色体结构开放程度高于基因组DNA; eccDNA中培强子元件促进基因表达
......
五、eccDNA的功能探索
eccDNA的功能正在被深入研究,虽然尚未完全理解,
但已经发现它们可能在多个生物学过程中存在着潜在的重要作用:
1. 癌基因扩增和癌症发展:
EccDNA中携带的癌基因可能在癌症发展中发挥关键作用。这包括EGFR、MYC等癌基因的扩增,促进异常细胞增殖(12)。
2. 遗传稳定性和基因拷贝数变异:
EccDNA的存在与基因拷贝数的变异和遗传稳定性有关,可能导致细胞内部基因组的多态性(10)。
3. 细胞应激响应和环境适应性:
EccDNA的形成可能是细胞对于应激和环境变化的一种适应性响应,参与细胞的生存机制(11)。
4. 细胞演化和遗传多样性:
EccDNA的存在可能增加细胞的遗传多样性,参与细胞演化的过程,提高对复杂环境的适应性(13)。
5. 细胞周期调控:
EccDNA可能与细胞周期的调控有关,特别是在细胞分裂和增殖阶段可能有一定的调节作用(14)。
五、eccDNA研究未来展望
尽管对eccDNA的研究取得了一些重要进展,但仍有许多未知领域需要探索。
未来的研究可能会更加深入地探讨eccDNA在基因组稳定性、细胞功能和疾病发生中的确切作用,
以及其在生物学和医学领域中的潜在应用价值。
图博基因提供专业的eccDNA测序与eccDNA合成服务,
目前已为众多国内著名高校、医院等科研院所提供eccDNA测序服务,积累了超过上千例的测序分析经验。
物种类型不仅包括人类、小鼠、果蝇、鱼类等动物,还包括狗牙根、拟南芥等植物。
图博基因提供的eccDNA合成技术,能快速高效的合成所需大小的eccDNA,用于下游的细胞功能验证。
更多信息请与我们联系
六、参考文献
1. Wu S, Turner KM, Nguyen N, Raviram R, Erb M, Santini J, et al. Circular ecdna promotes accessible chromatin and high oncogene expression. Nature. (2019) 575:699–703. doi: 10.1038/s41586-019-1763-5
2. Smith CA, Vinograd J. Small polydisperse circular DNA of hela cells. J Mol Biol. (1972) 69:163–78. doi: 10.1016/0022-2836(72)90222-7
3. Cesare AJ, Griffith JD. Telomeric DNA in alt cells is characterized by free telomeric circles and heterogeneous t-loops. Mol Cell Biol. (2004)24:9948–57. doi: 10.1128/MCB.24.22.9948-9957.2004
4. Tomaska L, Nosek J, Kramara J, Griffith JD. Telomeric circles:universal players in telomere maintenance? Nat Struct Mol Biol. (2009)16:1010–5. doi: 10.1038/nsmb.1660
5. Cohen S, Agmon N, Sobol O, Segal D. Extrachromosomal circles of satellite repeats and 5s ribosomal DNA in human cells. Mob DNA. (2010)1:11. doi: 10.1186/1759-8753-1-11
6. Shibata Y, Kumar P, Layer R, Willcox S, Gagan JR, Griffith JD, et al. Extrachromosomal microdnas and chromosomal microdeletions in normal tissues. Science. (2012) 336:82–6. doi: 10.1126/science.1213307
7. Møller HD, Mohiyuddin M, Prada-Luengo I, Sailani MR, Halling JF, Plomgaard P, et al. Circular DNA elements of chromosomal origin are common in healthy human somatic tissue. Nat Commun. (2018)9:1069. doi: 10.1038/s41467-018-03369-8
8. Dillon, L. W., Kumar, P., Shibata, Y., Wang, Y. H., Willcox, S., & Griffith, J. D. (2015). Production of Extrachromosomal MicroDNAs Is Linked to Mismatch Repair Pathways and Transcriptional Activity. Cell Reports, 11(11), 1749–1759.
9. Cohen, S., Agmon, N., & Sobol, O. (2018). Genomic DNA extrusion through mitotic cell death in tissue culture cells. Genes & Development, 32(11-12), 787–792.
10. Møller, H. D., & Parsons, L. (2019). Circular DNA and LINE-1 display over- replication-associated recombination products in human cancer cells. Nucleic Acids Research, 47(8), 3945–3955.
11. Shoura, M. J., Gabdank, I., Hansen, L., Merker, J., Gotlib, J., Levene, S. D., & Fire, A. Z. (2017). Intricate and Cell Type-Specific Populations of Endogenous Circular DNA (eccDNA) in Caenorhabditis elegans and Homo sapiens. G3: Genes, Genomes, Genetics, 7(10), 3295–3303.
12. Turner, K. M. et al. (2017). Extrachromosomal oncogene amplification drives tumour evolution and genetic heterogeneity. Nature, 543(7643), 122–125.
13. Dillon, L. W., Kumar, P., Shibata, Y., Wang, Y. H., Willcox, S., & Griffith, J. D. (2015). Production of Extrachromosomal MicroDNAs Is Linked to Mismatch Repair Pathways and Transcriptional Activity. Cell Reports, 11(11), 1749–1759.
14. Kohzaki, H., Murakami, Y., Sato, T., Hirose, S., Matsumoto, T., & Watanabe, M. (1993). DNA polymerase alpha is required for chromosomal DNA replication in Saccharomyces cerevisiae. Molecular and Cellular Biology, 13(2), 477–485.
15. CAO X K, WANG S, GE L, et al. Extrachromosomal circular DNA:category, biogenesis, recognition, and functions[J]. Front Vet Sci, 2021,8:693641.
16. Wang Tao*; Ruan Shasha*; Zhao Xiaolu; Shi Xiaohui; Teng Huajing; Zhong Jianing; You Mingcong; Xia Kun#; Sun Zhongsheng#; Mao Fengbiao#; OncoVar: an integrated database andanalysisplatform for oncogenic driver variants in cancers, Nucleic Acids Research, 2021, 49(D1): D1289-D 1301.